随着我国经济飞速发展与人民消费水平不断提高,国民对甜食及含糖饮料的喜爱度与日俱增[1]。自19世纪70年代起,高果糖玉米糖浆(High fructose corn syrup,HFCS)因甜度高、易获取、成本低等特点,代替蔗糖逐渐成为食品加工业中糖果、蛋糕、软饮料等产品的主要甜味添加剂之一[2]。越来越多的研究表明,长期摄入高含量的果糖会导致内脏脂肪积累、糖脂代谢紊乱、氧化应激和慢性轻度炎症等,成为诱发肥胖症、心脑血管疾病、非酒精性脂肪肝病、胰岛素抵抗等代谢综合征的危险因素[3-4]。因此,通过安全有效的膳食调节方式防治高果糖饮食诱导的相关代谢综合征成为了食品营养科学和健康领域亟待解决的重要问题。
茶作为一种具有促进健康作用的功能性食品和饮料,被人们广泛饮用。表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)作为绿茶中含量最高的多酚类物质组成成分之一,已被证明在缓解代谢障碍[5-6]及抗炎方面[7-8]效果显著。本文基于动物实验发现EGCG能够通过减少脂质积累、维稳血糖调节能力、修复肠道屏障及抑制炎症反应来良好地预防高果糖饮食引发的代谢紊乱。
一、EGCG对高果糖饮食小鼠体重、组织表征及血糖调节能力的改善作用
EGCG能够有效预防过量的脂质积累并维稳血糖调节能力。研究者发现,膳食补充1%EGCG能够在不影响小鼠的摄食量及日常行为活动的基础上,减轻脂质的过量积累及脂肪质量,缓解高果糖饮食诱导的小鼠体重增长。同时,它能够延缓高果糖饮食诱导的小鼠升糖水平,并缩短回稳至正常血糖水平的时间。
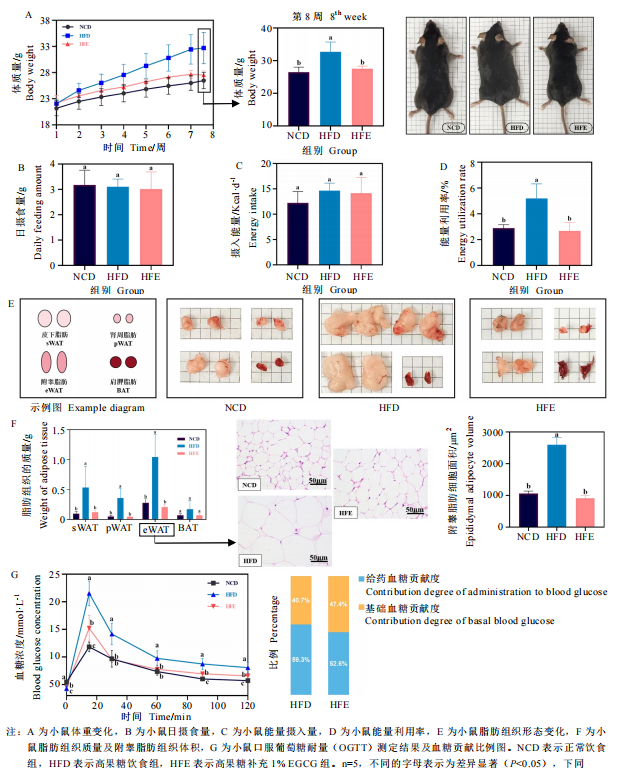
二、EGCG对高果糖饮食小鼠肝脏、肠道表征及炎症反应的改善作用
EGCG能够有效维稳高果糖饮食背景下的肝脏、肠道功能。肝脏和肠道都是人体的主要器官,在稳定血糖血脂水平、调节脂质代谢等方面具有重要作用。研究者发现,膳食补充1%EGCG能够显著降低高果糖饮食小鼠的肝脏重量,与正常组无异;并使肝脏中的脂滴及空泡面积显著下降,良好地改善了肝脂肪变情况。类似的,研究者发现高果糖饮食小鼠的肠道肠壁显著变薄、黏膜下层水肿、腺腔消失、腺体多数不完整、排列紊乱,具有明显的结构损伤;而喂食了EGCG的小数肠道腺体结构较为完整,腺腔排列状况明显改善,仅存在少数杯状细胞丢失现象。此外,EGCG还降低了肝脏中TNF-α、IL-1β炎症因子水平,肠道中的IL-6炎症因子水平。
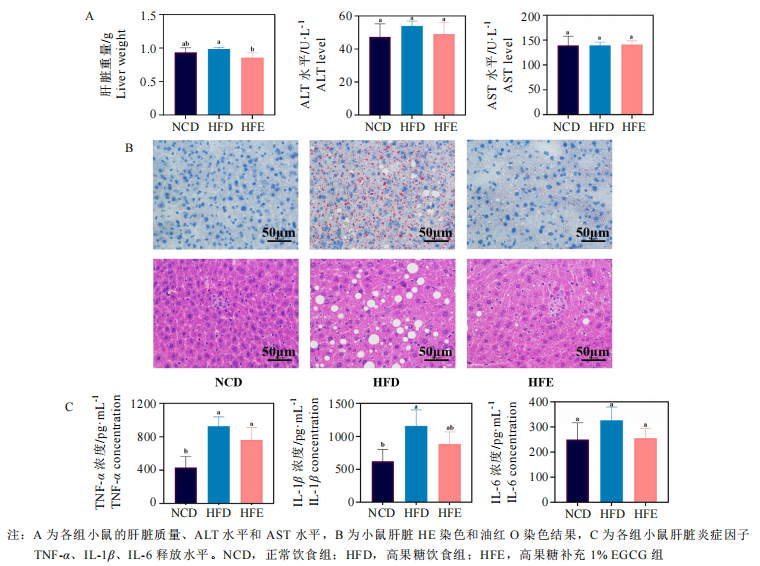
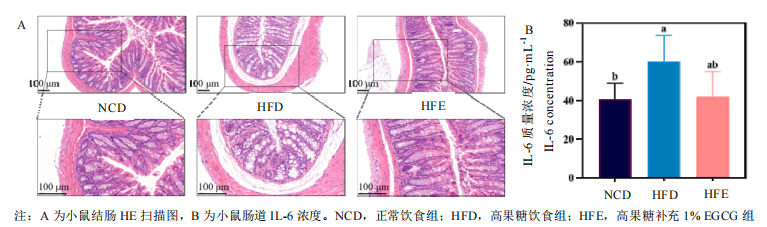
三、EGCG对高果糖饮食小鼠脂质代谢及炎症反应相关通路关键基因表达的影响
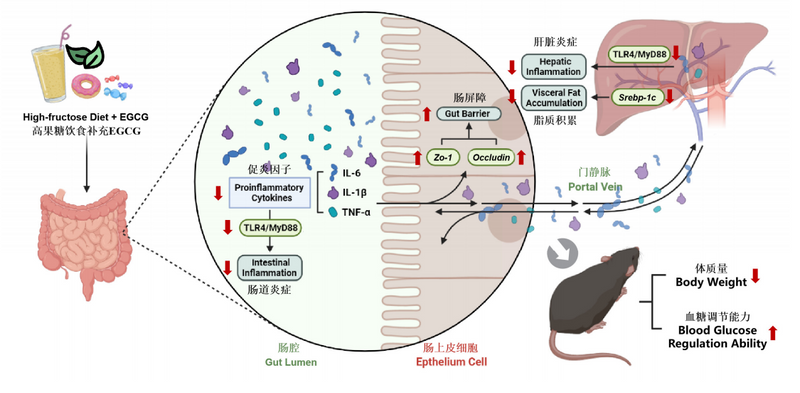
肝脏和肠道在果糖代谢中均占据着重要地位,它们能够通过门静脉系统实现营养成分及代谢产物的相互联系。我们通常将这个双向交流通路称作“肝-肠轴”[9]。
肠道屏障是肠道发挥功能的基础,ZO-1和Occludin作为促使肠道上皮细胞紧密连接的主要蛋白,与肠道通透性关系密切。TLR4/MyD88信号通路是介导炎性反应的重要通路,TLR4识别对应信号后,通过下游信号传递分子MyD88进行胞内信号传导,以至激活核因子-κB(Nuclear factor-κB,NF-κB),促使细胞分泌相关TNF-α、IL-6、IL-8、IL-1β等促炎因子诱导炎症的发生[10-11]。研究者发现,EGCG可能通过抑制肝脏脂质代谢Srebp-1c基因表达来调节高果糖饮食引起的脂质代谢紊乱,提高Zo-1基因表达水平,以及ZO-1和Occludin蛋白表达水平来保障肠道结构和功能,共同下调肝脏、肠道中Tlr4和Myd88基因表达水平来改善炎性情况。
综上,膳食补充EGCG可有效改善高果糖诱导的小鼠体重增加、脂质积累、血糖紊乱以及肝功能障碍,并可上调Zo-1基因表达水平、ZO-1和Occludin蛋白表达水平,以加强肠屏障功能,下调肝脏、肠道中IL-6、IL-1β、TNF-α促炎因子水平以改善炎症反应,其作用机制可能与抑制TLR4/MyD88信号通路有关。研究者从膳食多酚EGCG和肠-肝轴协同调控的角度揭示了膳食补充EGCG改善高果糖饮食诱导代谢紊乱的作用与机制,为EGCG防治高果糖相关代谢综合征及相关功能食品的开发提供了试验依据与研究基础。
【参考文献】
[1]任志斌,徐培培,张倩,等.2019—2021年中国11~14岁儿童甜食摄入量与近视的关系[J].卫生研究,2022,51(5):713-719.
[2]Hattori H,Hanai Y,Oshima Y,et al.Excessive intake of high-fructose corn syrup drinks induces impaired glucose tolerance[J].Biomedicines,2021,9(5):541.doi:10.3390/biomedicines9050541.
[3]Janevski M,Ratnayake S,Siljanovski S,et al.Fructose containing sugars modulate mRNA of lipogenic genes ACC and FAS and protein levels of transcription factors ChREBP and SREBP1c with no effect on body weight or liver fat[J].Food&Function,2012,3(2):141-149.
[4]Softic S,Meyer J G,Wang G X,et al.Dietary sugars alter hepatic fatty acid oxidation via transcriptional and post-translational modifications of mitochondrial proteins[J].Cell Metabolism,2019,30(4):735-753.
[5]Ren Z K,Yang Z Y,Lu Y,et al.Anti-glycolipid disorder effect of epigallocatechin3gallate on high-fat diet and STZ-induced T2DM in mice[J].Molecular Medicine Reports,2020,21(6):2475-2483.
[6]Xu L L,Li W W,Chen Z Q,et al.Inhibitory effect of epigallocatechin-3-O-gallate onα-glucosidase and its hypoglycemic effect via targeting PI3K/AKT signaling pathway in L6 skeletal muscle cells[J].International Journal of Biological Macromolecules,2019,125:605-611.
[7]Payne A,Nahashon S,Taka E,et al.Epigallocatechin-3-gallate(EGCG):new therapeutic perspectives for neuroprotection,aging,and neuroinflammation for the modern age[J].Biomolecules,2022,12(3):371.doi:10.3390/biom12030371.
[8]Wang M,Zhong H,Zhang X,et al.EGCG promotes PRKCA expression to alleviate LPS-induced acute lung injury and inflammatory response[J].Scientific Reports,2021,11(1):11014.doi:10.1038/s41598-021-90398-x.
[9]Febbraio M A,Karin M."Sweet death":fructose as a metabolic toxin that targets the gut-liver axis[J].Cell Metabolism,2021,33(12):2316-2328.
[10]Wilkinson N J,Peng L N,Doran J E,et al.Examination of the interplay between membrane tension and the tight junction protein,ZO-1[J].The FASEB Journal,2022,36(s1):R4270.doi:10.1096/fasebj.2022.36.S1.R4270.
[11]伍振辉,孟娴,胡佳伟,等.TLR4-MyD88-NF-kB信号通路与肝炎-肝纤维化-肝癌轴相关性研究进展[J].国际药学研究杂志,2017,44(5):396-401.
作者简介

陈蔚:硕士研究生在读,浙江大学茶叶研究所茶叶生物化学与综合利用团队成员,研究方向为茶功能成分利用与实际应用。
来源:中国茶叶学会、北京茶世界
如涉及版权问题请联系删除












